Согласно последним данным National Hospital Ambulatory Medical Care Survey в амбулаторной практике США ежегодно регистрируется более 7 млн. случаев инфекции мочевыводящих путей (ИМП), из них более 2 млн. обусловлены циститом.

Д.Ю. Пушкарь, А.В. Зайцев / Кафедра урологии Московского государственного медико-стоматологического университета (зав. кафедрой – проф. Пушкарь Д.Ю.)
В Великобритании в течение года около 2,5 млн женщин отмечают эпизоды расстройств мочеиспускания, из них у 100 000 диагностируется рецидивирующая ИМП (2). ИМП нередко наблюдается у молодых женщин в возрасте от 18 до 29 лет. В течение последующих 6-12 месяцев после первого эпизода ИМП у 25-50% из них развивается рецидив неосложненной ИМП.
Существуют различные виды классификации ИМП в зависимости от патогенетических механизмов, локализации процесса и других факторов, например, сопутствующих заболеваний. В настоящее время ИМП нередко делят на неосложненную и осложненную.
Неосложненная ИМП выявляется чаще у женщин с анатомически и функционально нормальными мочевыводящими путями.
Осложненная ИМП развивается на фоне нарушения уродинамики по обструктивному типу – при камнях различной локализации, стриктурах верхних мочевыводящих путей, инфравезикальной обструкции, а также у детей и лиц, перенесших различные медицинские манипуляции, что делает более трудными диагностику и лечение. Тяжелые формы ИМП требуют госпитализации и стационарного лечения.
В исследовании СОНАР (2005-2006 гг.) проанализированы данные о распространенности неосложненной ИМП в Российской Федерации, Республике Беларусь Казахстане и Кыргызстане. Полученные результаты свидетельствовали о том, что в возрасте 18-20 лет около 20% женщин имели в анамнезе, по крайней мере, один эпизод ИМП, а в более старших возрастных группах отмечен рост заболеваемости (3).
Наиболее частым клиническим проявлением НИМП, сопровождающимся расстройствами мочеиспускания и тазовыми болями, является цистит. Клиническое проявление заболевания зависит от типа уропатогенов, их вирулентности и резистентности к антимикробным агентам, а также, в известной степени, от общего состояния организма. Патогенез не всегда бывает достаточно ясен, многообразие специфических факторов, в том числе особенности взаимодействия между организмом пациента и внедрившимися микроорганизмами, определяет прогресс заболевания. Клинический опыт свидетельствует, что даже часто рецидивирующая неосложненная инфекция нижних мочевыводящих путей не всегда представляет угрозу для функции почек. Вместе с тем хорошо известен механизм «рефлюкс – пиелонефрита», развивающегося в отдельных случаях на фоне острого цистита. Адекватная и своевременно начатая антимикробная терапия у больных циститом не только приводит к более быстрому регрессу симптомов заболевания, но и является мерой профилактики поражения верхних мочевыводящих путей.
Рост резистентности основных уропатогенов ко многим антимикробным препаратам, как и имеющиеся недостатки «ультракоротких» режимов антибактериальной терапии (большая склонность к рецидивам), постоянно вызывает дискуссию о выборе эффективного метода лечения ИМП. Согласно существующим в настоящее время рекомендациям по лечению инфекционных заболеваний, главным образом тяжелых, возбудитель должен быть идентифицирован и профиль его чувствительности к антибиотикам определен до начала терапии. При лечении больных с острыми клиническими проявлениями ИМП в большинстве случаев получение своевременных данных о профиле чувствительности уропатогенов не всегда возможно и нецелесообразно сэкономической точки зрения. Поэтому, первоочередной задачей является мониторинг резистентности и, на этой основе, создание и актуализация терапевтических рекомендаций.
Характеризуя антибактериальные препараты, которые могут использоваться в эмпирической терапии и профилактике ИМП очевидно, что их антимикробный спектр должен быть адаптирован к основных возбудителей ИМП. Наиболее низкий уровень резистентности уропатогенов наблюдается в странах северной Европы и Австрии, а наиболее высокий – в Португалии и Испании. Последнее международное эпидемиологическое исследование при неосложненном цистите у женщин (ARESC) было проведено в 9 странах Европы (включая Россию) и Бразилии (4). В ходе этого исследования определялась чувствительность уропатогенов к девяти антибиотикам (назначаемым per os) на основании требований Института Клинических и Лабораторных Стандартов (CLSI). Согласно полученным данным основным уропатогеном являлась Escherichia coli (74,6%), далее Enterococcus faecalis (4,0%), Staphylococcus saprophyticus (3,6%), Klebsiella pneumoniae (3,5%) и Proteus mirabilis (3,5%). Как видно, на долю энтеробактерий призодится подавляющее большинство случаев ИМП.
В целях антибактериальной терапии неосложнённых ИМП используются различные классы препаратов. На протяжении многих лет более 20 цефалоспориновых антибиотиков успешно применяются для лечения самого широкого круга как внебольничных, так и нозокомиальных инфекций. Согласно данным исследования, проведенного в 2008 году Европейской Ассоциацией урологов, в антимикробном лечении больных, например, нозокомиальной ИПМ 32,5% урологов отдают предпочтение фтохинолонам, 32,3% – цефалоспоринам (19,2% применяют цефалоспорины 3-го поколения), 12,3% – аминогликоидам и 9,5% специалистов применяют карбапенемы (5). Отличительной чертой цефалоспоринов 3-го поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию β – лактамаз некоторых бактерий, длительный период полувыведения, что позволяет назначать данные препараты 1-2 раза в сутки. В условиях роста резистентноти уропатогенов к фторхинолонам и котримоксазолу, цефалоспорины 3-го поколения могут сохранить свою роль в лечении неосложненной ИМП у амбулаторных больных, когда вероятность инфицирования мочевыводящих путей штаммами, продуцирующими β – лактамазы расширенного спектра действия, является невысокой. В отличии от таких антибиотиков, как фторхинолоны и котримоксазол, цефалоспорины можно применять у детей и беременных женщин. Одним из наиболее изученных цефалоспоринов 3-го поколения для перорального приема является цефиксим, зарегистрированный в России под торговым названием “Цефорал Солютаб” (Астеллас Фарма Юроп Б.В., Нидерланды).
Фармакокинетика и фармакодинамика цефиксима
Цефиксим является полусинтетическим цефалоспорином 3-го поколения для перорального применения, представляет собой [6R-[6альфа,7бета(Z)]]-7-[[(2-Амино-4-тиазолил) [(карбоксиметокси)имино]ацетил]амино] -3-этенил-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновую кислоту. Препарат имеет замещающую гидроксиимино-аминотиазоловую боковую цепь в 7-й позиции. Это обеспечивает, по сравнению с представителями I–II поколений, высокую стабильность к β-лактамазам широкого спектра действия. Дополнительно введенная метоксиимино – группа ещё больше повышает устойчивость к β-лактамазам грамотрицательных бактерий.
Проявляет высокую активность в отношении: Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Proteus mirabilis, Proteus vulgaris, Citrobacter diversus, Providencia rettgeri, Neisseria gonorrhoeae. Не действует на: Staphylococcus aureus, Pseudomonas aeruginosa.
Цефиксим обладает высокой биодоступностью, которая составляет 40 – 52%. При этом следует отметить, что прием пищи не оказывает существенного влияния на биодоступность и фармакокинетику препарата (6,7). Также было выявлено, что одновременный прием цефиксима с антацидами не оказывает значимого влияния на такие фармакокинетические параметры как пиковая концентрация препарата в плазме (Cmax) или площадь под фармакокинетической кривой (ПФК) (8,9).
После приёма препарата в дозе 400 мг, Cmax цефиксима в сыворотке достигается между 3 и 5 часом, медиана времени достижения пиковой концентрации (Tmax) составляет 4 ч. Пиковые концентрации в тканях достигаются позднее чем в сыворотке, Tmax для тканей составляет 6,7 ч (10).
В среднем, 20% цефиксима выводится в неизмененном виде почками в течение 24 часов при пероральном приеме препарата в дозе 200 мг, при внутривенном введении 200 мг цефиксима в течение 24 часов с мочой выводится в неизмененном виде 40,8% препарата. Аналогичный показатель при приеме внутрь составляет 21% для препарата принятого в виде суспензии; 18% при приеме препарата в капсулах (10).
Цефиксим создает высокие концентрации во многих органах и тканях. В моче цефиксим создает высокие концентрации, во много раз превышающие МПК большинства микроорганизмов, вызывающих ИМП. Изучено содержание цефиксима в моче при приеме препарата по 200 мг 2 р/с и 400 мг 1 р/с в течение 15 дней . На 15 день, через 2-4 часа после приема последней дозы препарата, концентрация цефиксима в моче составила 29 мг/л при приеме в дозе 200 мг 2 р/с и 43 мг/л при приеме в дозе 400 мг 1 р/с (11). Наряду с другими представителями β-лактамов, цефиксим обладает бактерицидным действием, нарушая синтез клеточной стенки бактерий, каркас которой составляют пептидогликаны. Активность препарата обусловлена высоким сродством к пенициллинсвязывающим белкам (ПСБ) 3, 1a и 1b. Сродство в отношении ПСБ-1b объясняет высокую антимикробную активность цефиксима, сходную с другими пероральными цефалоспоринами – цефаклором и цефалексином. Отсутствие же активности цефиксима в отношении S.aureus и коагулазонегативных стафилококков может быть объяснено низким сродством цефиксима к ПСБ-2 (12-14).
Клиническая эффективность цефиксима при ИМП
Неосложненные ИМП. Большая часть клинических исследований цефиксима при неосложненных ИМП проводились преимущественно у пациентов с острым циститом, так как эта нозология является доминирующей в структуре внебольничных неосложненных ИМП. Наиболее часто для лечения данного заболевания использовали цефиксим в дозе 100 мг 2 р/с, в течение 3-7 дней.
В исследовании японских ученых, включавшее 35 женщин с острым неосложненным циститом, цефиксим назначали по 100 мг 2 р/с, в среднем в течение 3,9 дней. Клиническая эффективность и эрадикация возбудителя наблюдалась в 100% случаев (15).
Больший интерес представляют данные сравнительных рандомизированных исследований. Так, в Германии было проведено рандомизированное двойное слепое плацебо – контролируемое исследование эффективности однократного приема цефиксима, офлоксацина, ко-тримоксазола или плацебо в лечении неосложненных ИМП. В исследовании участвовали 80 женщин в возрасте от 18 до 35 лет с неосложненными ИМП. Пациентки случайным образом были распределены в одну из групп: принимавших однократно цефиксим в дозе 400 мг, офлоксацин 200 мг, ко-тримоксазол 160/800 мг или плацебо, эффективность проводимой терапии оценивали через 14-17 дней. Терапия считалась эффективной при отсутствии бактериурии и клинической симптоматики. В данном исследовании было показано, что терапия цефиксимом эффективна в 89,4% случаев, офлоксацином в 89,4%, ко-тримоксазолом в 84,2% и плацебо в 26,3% (16).
Эффективность терапии неосложненных ИМП цефиксимом и ко-тримоксазолом изучали в двойном слепом исследовании, в которое было включено 528 пациентов, которые случайным образом разделенные на 3 группы: принимавшие цефиксим по 400 мг 1 р/с, по 200 мг 2 р/с и ко-тримоксазол (триметоприм 160 мг + сульфаметоксазол 800 мг) по 1 таблетке 2 р/с. Через 5-9 недель проводилась клиническая и микробиологическая оценка терапии. Исследование продемонстрировало равноценную микробиологическую эффективность препаратов во всех группах: прием цефиксима по 400 мг был эффективен в 100% случаев, по 200 мг в 97%, а ко – тримоксазол у 98% пациентов (17).
Американскими учеными было проведено многоцентровое исследование, выполненное для сравнения эффективности цефиксима и амоксициллина у 565 взрослых пациентов с неосложненными ИМП. Случайным образом пациенты были разделены на 2 группы: пациенты из первой группы (n=279) принимали цефиксим по 400 мг 1 р/с в течение 10 дней, а пациенты из второй группы (n=286) принимали амоксициллин в дозе 250 мг 3 р/с на протяжении 10 дней. Эффективность терапии оценивали через 7 дней после окончания лечения. Клиническая эффективность цефиксима составила 90%, а амоксициллина 83%, эрадикация уропатогенов наблюдалась у 92% пациентов, лечившихся цефиксимом и у 84% пациентов, принимавших амоксициллин (18).
На базе двух центров (МЛПУ поликлиника №3 г. Смоленск и ОГУЗ Калужская областная больница, г. Калуга) проведено сравнительное открытое проспективное рандомизированное исследование эффективности применения цефиксима и ципрофлоксацина в лечении больных острым циститом (19). Всего в исследование было включено 104 пациента, из них 49 рандомизированы в группу 1 (терапия цефиксимом), 55 в группу 2 (терапия ципрофлоксацином). Средний возраст пациентов составил 33,2 ± 11,5 лет. Возникновение клинической картины острого цистита, в среднем, отмечалось за 3,1 ± 1,9 дней до обращения за медицинской помощью. Наличие фоновой патологии у пациентов было зафиксировано в 4,1% случаев, при этом все женщины с наличием фоновой патологии получали цефиксим (группа 1).
В рамках исследования проводился промежуточный статистический анализ сравнительной бактериологической эффективности изучаемых режимов терапии после достижения популяции включенных пациентов в количестве 42 человек. В ходе этого анализа установлена достоверно более низкая бактериологическая эффективность1 ципрофлоксацина 250 мг 2 раза в сутки по сравнению с таковой цефиксима 400 мг 1 раз в сутки. Частота эрадикации составила соответственно 55,6% и 100% в группах пациентов, получавших ципрофлоксацин и цефиксим, различия были статистически достоверны (p<0,05). Основные параметры эффективности и безопасности сравниваемых препаратов представлены в табл. 1. Таблица 1. Клиническая и бактериологическая эффективность цефиксима в дозе 400 мг 1 раз в сутки и ципрофлоксацина в дозе 250-500 мг 2 раза в сутки в течение 5 дней у пациентов с острым неосложненным циститом
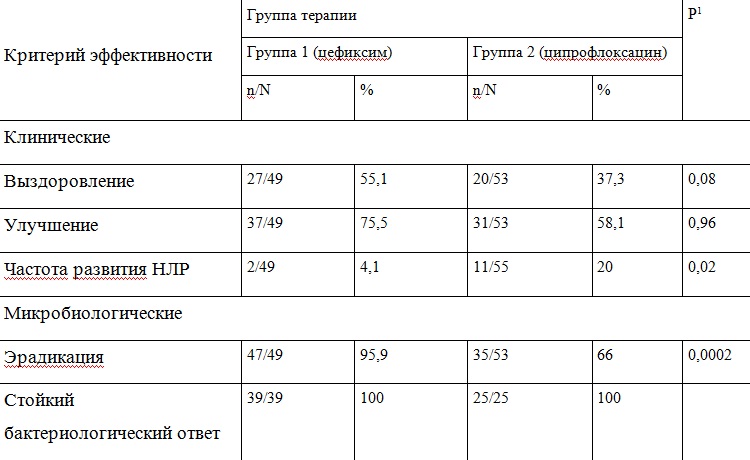
Клиническое выздоровление (полное исчезновение всех симптомов), не являющееся основным маркером эффективности препарата при ИМП, наблюдалось у 55,1% пациентов из группы 1 (цефиксим 400 мг) и у 37,3% пациентов группы 2 (ципрофлоксацин 250-500 мг), а улучшение – в 75,5% и 58,1%, соответственно. Разница не была статистически достоверной (p=0,08). Эрадикация возбудителя (элиминация возбудителя, выделенного на визите 1, при проведении исследования на визите 2, при условии отсутствия других клинически значимых возбудителей) отмечалась у 95,9% пациентов группы 1 и 66% пациентов группы 2 (разница статистически достоверна, p=0,0002).
В результате установлено, что клиническая эффективность обоих режимов терапии ОНЦ была ниже микробиологической. Авторы справедливо отмечают, что клиническая эффективность нередко «отстает» от микробиологической. Несмотря на эрадикацию уропатогена воспалительные явления в тканях мочевого пузыря некоторое время сохраняются, поэтому этот показатель является более субъективным. В настоящее время эрадикация уропатогенов является наиболее объективным методом контроля эффективности антимикробной терапии ИМП.
В данном исследовании был использован урологами в РФ генерик ципрофлоксацина. Нельзя исключить, что эффективность оригинального ципрофлоксацина или воспроизведенных форм от других производителей может отличаться.
Осложненная ИМП. Под осложненной ИМП подразумевают инфекцию, возникающую на фоне структурных или функциональных нарушений мочевыводящих путей, или на фоне сопутствующих заболеваний, влияющих на защитные механизмы макроорганизма и повышающих риск развития реинфекции, рецидива или неэффективности лечения. Нозокомиальная ИМП, а также ИМП, вызванная резистентными штаммами микроорганизмов, относятся к осложненной. К микробиологическим особенностям осложненных ИМП относятся более широкий этиологический спектр, снижение роли E.coli, более высокая частота выделения резистентных бактерий, чем при неосложненных ИМП. К клиническим особенностям осложненных ИМП относят склонность к рецидивированию, более низкая эффективность антимикробной терапии.
Цефиксим исследовали у пациентов с относительно нетяжелыми формами осложненных ИМП – хроническим осложненным циститом и хронический осложненным пиелонефритом. В основном для терапии данных ИМП использовали цефиксим в дозе 200 мг 2 р/с, у небольшой части пациентов использовали дозу 400 мг 1 р/c. В целом, клинический опыт исследования цефиксима у пациентов с осложненными ИМП меньше, чем при неосложненных.
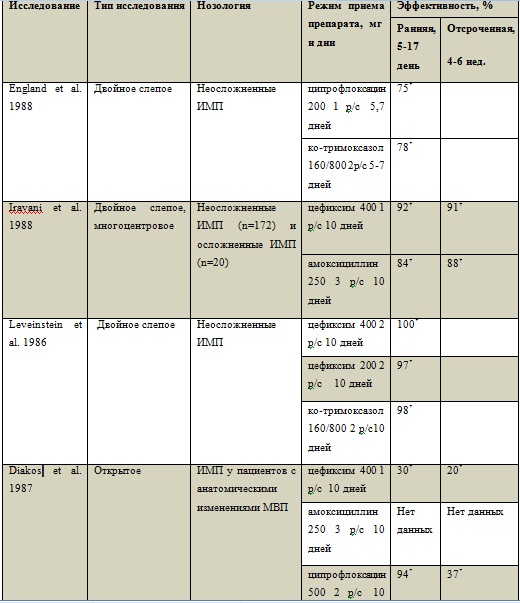
В серии исследований было установлено, что микробиологическая эффективность цефиксима при терапии осложненных ИМП составляла не менее 69% (20-24).
Основные уропатогены, вызывавшие инфекции мочевого тракта, принадлежали семейству Enterobacteriaceae, доминировала E.coli , которая элиминировалась во время лечения у 155 из 223 (69,5%) пациентов. В исследовании с участием 79 пациенток с осложненными ИМП, принимавших по 100 мг цефиксима 2 р/с, на протяжении 5,9 дней, клиническая эффективность терапии составила 63%, а эрадикация возбудителя наблюдалась у 79% пациенток (15). Данные об исследованиях по применению цефиксима при различных нозологиях из группы ИМП представлены в таблице 2.
Таблица 2.
Результаты сравнительных исследований применения цефиксима при лечении ИМП (сводные данные)
Применение цефиксима в качестве компонента ступенчатой антибактериальной терапии
Одним из достоинств цефиксима является возможность его использования в качестве пероральной части при проведении ступенчатой антибактериальной терапии ИМП.
Испанскими учеными было проведено рандомизированное контролируемое исследование по сравнению эффективности ступенчатой терапии острого неосложненного пиелонефрита с использованием 7 и 14 – дневной терапии цефиксимом (24). В исследовании участвовали 304 женщины, получившие однократно в/в инънкцию 1 г цефтриаксона, а затем случайным образом разделенные на группы: пациентки из 1 группы (n=153) после инъекции получали перорально по 400 мг цефиксима 1 р/с 7 дней, а пациентки из 2 группы (n=151) принимали цефиксим по 400 мг 1 р/с на протяжении 14 дней. В 96,6% случаев заболевания вызывались E.coli. Клиническая и микробиологическая эффективность терапии оценивалась спустя 10-15 дней и 4-6 недель. Микробиологическая эффективность была достигнута в 79% случаев у пациенток из 1 группы и в 75,2% во 2 группе. Клиническая эффективность лечения была зарегистрирована в 92,2% случаев у пациенток из 1 группы и у 92,7% пациенток из 2 группы (25).
В многоцентровом рандомизированном клиническом исследовании была подтверждена эффективность и безопасность как самостоятельного приема цефиксима, так и его применения в качестве перорального компонента ступенчатой антибактериальной терапии ИМП, сопровождающихся подъемом температуры у детей (26). В исследовании участвовало 306 детей в возрасте от 1 месяца до 2 лет с ИМП, сопровождающимися повышением температуры. Пациенты были разделены на группы: 1-принимавшие цефиксим в дозе 8 мг/кг 1 р/с в течение 14 дней и 2-получавшие в/в инъекции цефотаксима по 200 мг/кг/с ( суточная доза была разделена на 4 введения) 3 дня или до тех пор, пока ректальная температура в течение 24 часов не будет ниже 38°С, затем данная группа пациентов получала перорально цефиксим, до достижения длительности курса терапии 14 дней. Стерильность мочи у пациентов из первой группы была достигнута через 25 часов от начала лечения, а во 2 через 24 часа. В течение 6 месяцев после окончания терапии клинические и микробиологические симптомы рецидива инфекции отмечались у 5,3% детей, получавших цефиксим перорально и у 8,5% детей, получавших ступенчатую терапию. Эпизоды бессимптомной бактериурии отмечались у 1 пациента, получавшего пероральную терапию, и у 2 детей, получавших ступенчатую терапию. Через 6 месяцев после проведения терапии морфологические изменения в почках наблюдались у 9,8% детей, принимавших цефиксим пероральную и у 7,2% пациентов, получавших ступенчатую терапию (26).
Антибиотикорезистентность уропатогенной E.coli к цефиксиму
В связи с тем, что уропатогенная E.coli является возбудителем ИМП в подавляющем большинстве случаев, следует уделять особое внимание мониторингу устойчивости к антибактериальным препаратам именно данного микроорганизма (27-28).
На основании имеющихся зарубежных и отечественных данных можно сделать вывод о невысоком уровне резистентности к цефиксиму основного возбудителя внебольничных ИМП, E.coli, в разных странах (таблица 3.).
Таблица 3.
Резистентность уропатогенной E.coli к цефиксиму (сводные данные)

Полученные данные позволяют сделать вывод о вариабельности частоты выделения штаммов уропатогенной E.coli, устойчивых к цефиксиму в разных странах. Тем не менее, в России наблюдается минимальная устойчивость этого возбудителя, что позволяет уверенно рекомендовать применение препарата в лечении пациентов, страдающих неосложненными ИМП. В условиях растущей резистентности возбудителей к традиционно используемым антибактериальным препаратам цефиксим (Цефорал Солютаб) становится одним из антибиотиков первого выбора для лечения НИМП.